【】যোজনী ও জারণ সংখ্যার মধ্যে পার্থক্য
যোজনী ও জারণ সংখ্যার মধ্যে পার্থক্য
*নিম্নে যোজনী ও জারণ সংখ্যার মধ্যে পার্থক্যগুলো উল্লেখ করা হলো:
পার্থক্য-০১: সংজ্ঞাভিত্তিক পার্থক্য
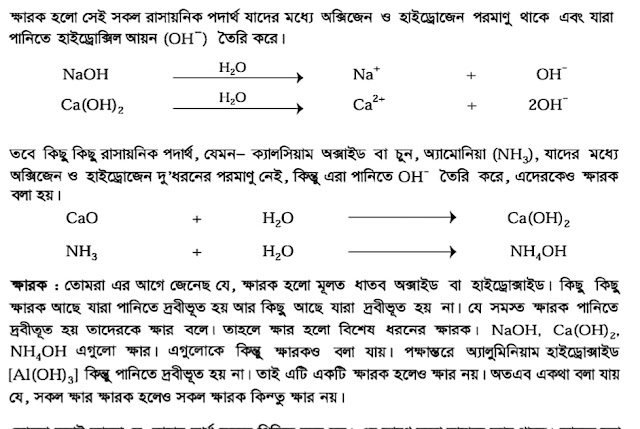
কোন একটি মৌলের যোজনী হলো অপর কোন মৌলের সাথে যুক্ত হবার ক্ষমতা। যোজনীর কোন ধনাত্মক অথবা ঋণাত্মকতা নেই।
অপরদিকে কোন একটি নির্দিষ্ট যৌগেকোন একটি নির্দিষ্ট মৌলের জারণ সংখ্যা বলতে এমন একটি সংখ্যাকে বোঝায়, যা দ্বারা সংশ্লিষ্ট মৌলের বা পরমাণুতে সৃষ্ট তড়িৎ চার্জের প্রকৃতি ও সংখ্যামান উভয়ই প্রকাশ পায়। উল্লেখ্য যে, জারণ সংখ্যা ধনাত্মক, ঋণাত্মক বা শূন্য হতে পারে। নিচের উদাহরণগুলো লক্ষ্য করো:
MgO যৌগে Mg এর যোজনী হল ২; কিন্তু MgO এ Mg এর জারণ সংখ্যা হল +২।
অনুরূপভাবে, মিথেন যৌগে (CH₄) C এর যোজনী হল 4; কিন্তু মিথেন যৌগের কার্বনের (C) জারণ সংখ্যা হল -4 ।
*পার্থক্য-০২: বিভিন্ন যৌগে যোজনী ও জারণ সংখ্যা
একটি মৌলের বিভিন্ন যৌগে যোজনী সংখ্যা একই হলেও বিভিন্ন জারণ সংখ্যা হতে পারে। যেমন কার্বনের সব যৌগে কার্বন চতুর্যোজী বা যোজনী ৪ হলেও নিম্নোক্ত যৌগসমূহে কার্বনের জারণ সংখ্যা ভিন্ন ভিন্ন হয়েছে।
যৌগসমূহ জারণ সংখ্যা
১।CCl₄ +4
(কার্বন টেট্রাক্লোরাইড)
২।CH₂Cl₂ 0
(ডাইক্লোরোমিথেন)
৩।C₂H₂ -1
(ইথাইন)
৪।CH₄ -4
(মিথেন)
*পার্থক্য-০৩: পূর্ণ সংখ্যায় যোজনী
মৌলের যোজনী সব সময় পূর্ণ সংখ্যা। কিন্তু মৌলের জারণ সংখ্যা ভগ্নাংশ হতে পারে।যেমন, ফেরোসোফেরিক অক্সাইড যৌগে(Fe₃O₄) একটি Fe এর যোজনী 2 এবং অপর দুটি Fe এর প্রত্যেকের যোজনী 3 [কারণ Fe₃O₄ =FeO + Fe₂O₃] কিন্তু Fe₃O₄ এ Fe এর জারণ সংখ্যা + 2.66 ।
*পার্থক্য-০৪: পরমাণুর জারণ সংখ্যা শূন্য
মৌলিক অবস্থায় সব পরমাণুর জারণ সংখ্যা শূন্য এবং কোন বিশেষ যৌগের অণুতে(যেমন ডাইক্লোরো মিথেন (CH₂Cl₂) এ কার্বন পরমাণুর জারণ সংখ্যা শূন্য) কোন একটি পরমাণুর বা মৌলের জারণ সংখ্যা শূন্য হতে পারে কিন্তু নিষ্ক্রিয় গ্যাস মৌলের পরমাণু যেমন He,Ne ইত্যাদি ছাড়া কোন পরমাণুর যোজনী কখনো শূন্য হয় না।


Kon book theke point gulo neya hoyeche jante pari?4 no. Point ti jaron sonkhar khetre 1 jon teacher vul bolche.kintu ami mone korchi point ti thik ase.tai source ta amk janale ami teacher er samne ta present korte pari.
ReplyDeleteআরে ভাই,,, যোজনীওতো ভিন্ন হইতে পারে এটা সব যৌগে কিভাবে একই থাকে। যেমন:- SCL2, SCL4,SCL6 এ যৌজনী যথাক্রমে 2,4,6.
ReplyDelete