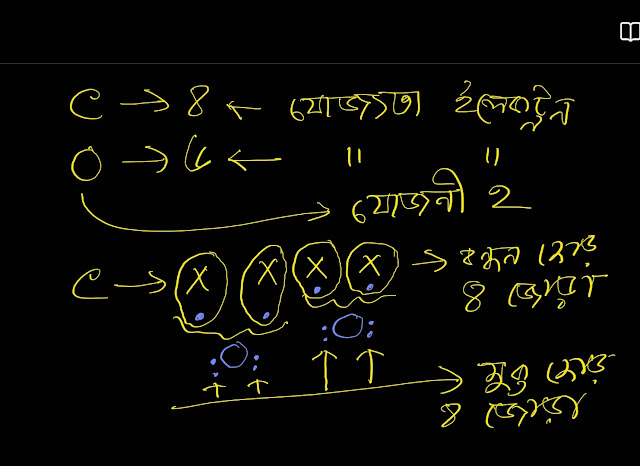
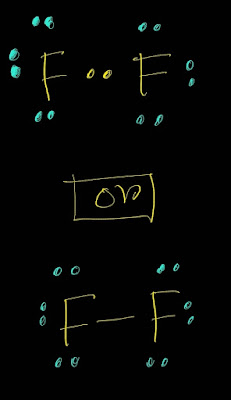
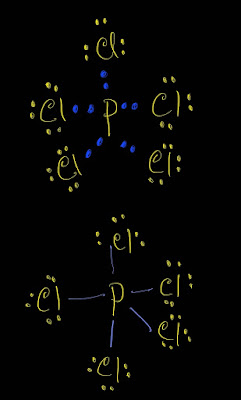
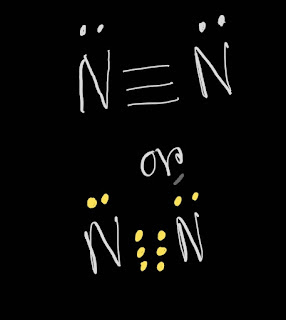
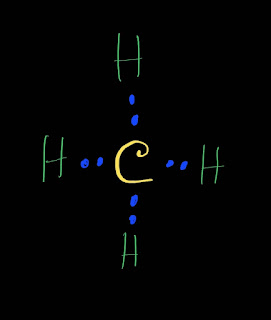
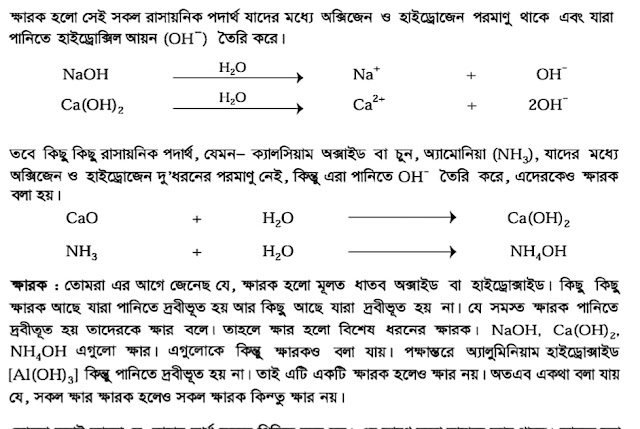
CaO (ক্যালসিয়াম অক্সাইড) একটি ক্ষারক(Base)।এর কারণ হচ্ছে ইহা এসিডের সাথে বিক্রিয়া করে লবণ(Salt) ও পানি তৈরি করে। উদাহরণ হিসেবে সালফিউরিক এসিডের সাথে ক্যালসিয়ামের অক্সাইডের বিক্রিয়া আলোচনা করা হলো: ক্ষারক CaO(ক্যালসিয়ামের অক্সাইড) এসিড H₂SO₄ এর সাথে বিক্রিয়া করে লবণ ক্যালসিয়াম সালফেট (CaSO₄) ও পানি (H₂O) উৎপাদন করে। CaO + H₂SO₄ ---->CaSO₄ +H₂O আবার,ক্ষারক CaO (ক্যালসিয়ামের অক্সাইড) এসিড HCl এর সাথে বিক্রিয়া করে লবণ CaCl₂ ও পানি (H₂O) উৎপাদন করে। CaO + HCl ---->CaCl₂ +H₂O উল্লেখ্য যে,CaO ক্ষারক(Base) হলেও ক্ষার(Alkali) নয়। যে সকল ক্ষারক পানিতে দ্রবীভূত হয়, তাদের ক্ষার(Alkali) বলে।CaO পানিতে দ্রবীভূত হয় না।ফলে ইহা ক্ষার নয়।ক্ষার(Alkali) এর উদাহরণ হচ্ছে Na₂O,K₂O,NaOH,KOH,NH₄OH ইত্যাদি। আরো পড়ুন: সব ক্ষারই ক্ষারক কিন্তু সব ক্ষারক ক্ষার নয় ক্ষার এবং ক্ষারকের পার্থক্য
.jpg)