মুক্তজোড় ও বন্ধন জোড় ইলেকট্রন বের করার নিয়ম
Shortcut Method(1st ):
CO2 এর ক্ষেত্রে:
CO2, কার্বন-ডাই-অক্সাইড যৌগের মুক্তজোড় ও বন্ধন জোড় ইলেকট্রন বের করার করার জন্য প্রথমে কেন্দ্রীয় পরমাণুর মুক্তজোড় ও বন্ধন জোড় ইলেকট্রন সংখ্যা বের করতে হবে।
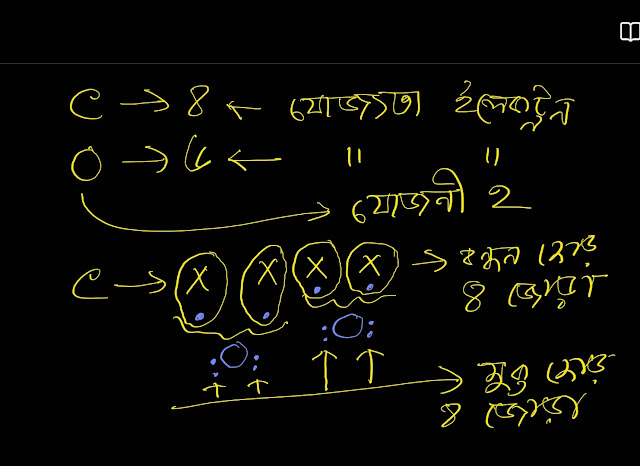
কেন্দ্রীয় পরমাণু হচ্ছে ওই পরমাণুটি তার ইলেকট্রোনেগেটিভিটি সবচেয়ে কম।CO2 এর ক্ষেত্রে কেন্দ্রীয় পরমাণু হচ্ছে কার্বন পরমাণু। কারণ হচ্ছে অক্সিজেনের চেয়ে কার্বনের ইলেকট্রোনেগেটিভিটি কম।
এখন কেন্দ্রীয় পরমাণুর যোজ্যতা ইলেকট্রন বা ভ্যালেন্সি ইলেকট্রন বিবেচনা কর এবং বাইরের পরমাণুর যোজনী বিবেচনা কর।
কার্বনের যোজ্যতা ইলেকট্রন হচ্ছে ৪ ।এর কারণ হলো ইহা পর্যায় সারণির 4A গ্ৰুপে অবস্থিত। আর অক্সিজেনের যোজনী ২।এর কারণ হলো অক্সিজেন পর্যায় সারণিতে 6A গ্ৰুপে অবস্থিত হওয়ায় এর যোজ্যতা ইলেকট্রন ৬ এবং ফলে অষ্টক পূরণের জন্য আরও ২ ইলেকট্রনের প্রয়োজন। অর্থাৎ অক্সিজেন দুইটি বন্ধন গঠন করতে পারে।
CO2 তে দুইটি অক্সিজেন পরমাণু ৪ টি বন্ধন গঠন করতে পারবে।আমরা জানি যে,একটি বন্ধন গঠন করতে দুটি ইলেকট্রনের প্রয়োজন, যার একটি আসবে কার্বন থেকে আর একটি আসবে অক্সিজেন থাকে।ফলে কার্বনের ৪টি যোজ্যতা ইলেকট্রনের মধ্যে ৪ টিই ব্যবহৃত হয়।কোন মুক্ত জোড় ইলেকট্রন কার্বনে উপর নেই।
অপরদিকে,প্রতিটি অক্সিজেন পরমানুর উপর ২ জোড়া মুক্ত জোড় থাকবে। CO2 যৌগে মুক্ত জোড় ৪ জোড়া এবং বন্ধন জোড় ৪ জোড়া পাওয়া যায়।
উপরিউক্ত নিয়ম অনুযায়ী সহজেই আপনি অনেক যৌগের মধ্যে মুক্ত জোড় ও বন্ধন জোড় ইলেকট্রন সংখ্যা গণনা করতে পারেন।
আরো বিস্তারিত:
কার্বন ডাই অক্সাইডের(CO2) লুইস ডট চিত্র আঁকার জন্য প্রথমে আমাদেরকে কার্বন-ডাই-অক্সাইড যৌগের মধ্যে যতগুলো ভ্যালেন্সি ইলেকট্রন বা যোজ্যতা ইলেকট্রন আছে তা গণনা করতে হবে।
কার্বন (C) পর্যায় সারণির 4A এ গ্রুপে অবস্থিত। ফলে কার্বনের যোজ্যতা ইলেকট্রন বা ভ্যালেন্স ইলেকট্রন হল 4। অধিকিন্তু, অক্সিজেনের পর্যায় সারণিতে অবস্থান হল 6A তে। ফলে অক্সিজেনের যোগ্যতা ইলেকট্রন হলো 6 ।
CO2 তে (4 + 6×2) = 4 + 12 = 16 টি যোজ্যতা ইলেকট্রন বা ভ্যালেন্সি ইলেকট্রন রয়েছে।
এই 16 টি যোজ্যতা ইলেকট্রন বা ভ্যালেন্সি ইলেকট্রনের দুইটি কাজ রয়েছে যা একসাথে করে থাকে।প্রথম কাজটি হল তিনটি পরমাণুকে সংযুক্ত করা এবং দ্বিতীয় কাজটি হলো,তাদের অষ্টক পূর্ণ করতে সহায়তা করা।
উল্লেখ্য যে এখানে কার্বন হল কেন্দ্রীয় পরমাণু আর অক্সিজেন হলো বাইরের পরমাণু। কার্বন এখানে কেন্দ্রীয় পরমাণু ।এর কারণ হলো কার্বনের ইলেকট্রনেগেটিভিটি অক্সিজেন এর চাইতে কম।
এখন যেকোনো দুইটি পরমাণুকে সংযুক্ত করার জন্য আমরা দুটি যোজ্যতা ইলেকট্রনকে ব্যবহার করব এবং যোজ্যতা ইলেকট্রনকে ডট রূপে প্রকাশ করব।
CO2 এর লুইস ডট চিত্র থেকে দেখা যায় যে,প্রত্যেকটি অক্সিজেন পরমাণুতে দুই জোড়া মুক্ত জোড় ইলেকট্রন আছে কিন্তু কার্বন পরমানুতে কোন মুক্ত জোড় নেই।আরো দেখা যায় যে,একটি কার্বন পরমাণু ও দুইটি অক্সিজেন পরমানুর মাঝে চার জোড়া বন্ধন জোড় ইলেকট্রন বিদ্যমান।
Read More:CO2 লুইস চিত্র
অ্যামোনিয়া অণুতে (NH3)মুক্ত জোড় ও বন্ধন জোর ইলেকট্রন সংখ্যা বের করার নিয়ম:https://toffeelive.com/#video/2bfaa36d7ddcf20874fd88f1a7741ad9







Comments
Post a Comment